 塩基 : プロトン受容体
P>8.1.1 共役酸・共役塩基
塩基 : プロトン受容体
P>8.1.1 共役酸・共役塩基 酸 : プロトン (H+) 供与体
 塩基 : プロトン受容体
P>8.1.1 共役酸・共役塩基
塩基 : プロトン受容体
P>8.1.1 共役酸・共役塩基
| 酸1 | 塩基2 | 共役塩基1 | 共役酸2 | ||||
| HCl | + | H2O | 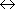 |
Cl- | + | H3O+ | (8.1) |
| ・Cl- は HCl の共役塩基、
H3O+ は H2O の共役酸 ・酸 HCl はプロトンを放出して共役塩基 Cl- になる | |||||||
| H2O | + | NH3 | 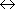 |
OH- | + | NH4+ | (8.2) |
| ・塩基 NH3
はプロトンを受容して共役酸 NH4+ になる | |||||||
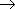 HPO42- + OH-
HPO42- + OH- H3O+
+ NO3-
H3O+
+ NO3-
8.1.2 酸性度定数
| (8.1) : | Ka = [H3O+][Cl-] / [HCl], | pKa = - log10 Ka |
| (8.2) : | Kb = [NH4+][OH-] / [NH3], | pKb = - log10 Kb |
8.1.3 酸性度の傾向
<水素酸>
周期律表 - Ka 大
- Ka 大
ex.) H2Te (pKa = 2.64) >
H2Se (3.72) > H2S (7.02) >
H2O (15.7)
<オキソ酸>
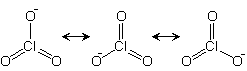
共鳴安定化 (共役塩基) 大 - Ka 大
| ex.) 塩素酸 : | Cl(OH) | ClO(OH) | ClO2(OH) | ClO3(OH) |
| 次亜塩素酸 | 亜塩素酸 | 塩素酸 | 過塩素酸 | |
| 局在構造数 | 1 | 2 | 3 | 4 |
| pKa | 7.2 | 2.0 | -1 | -10 |
Pauling 則
1) XOn (OH)m :
pKa 〜 8 - 5n
2) 多価酸の逐次解離 : pKa (i )
〜 pKa (i - 1) + 5
<無水酸化物>
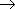 H2CO3
H2CO3
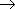 H3O+ +
HCO3-
H3O+ +
HCO3-
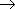 H3O+ +
CO32-
H3O+ +
CO32-
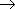 Ca2+ + 3 H2O
Ca2+ + 3 H2O
 2
[Al(OH2)6]3+
2
[Al(OH2)6]3+
 2
[Al(OH)4]-
2
[Al(OH)4]-
酸化物が両性 : 金属-非金属の境界領域で見られる
( と強く関連)
と強く関連)
 塩基 : 電子対供与体
塩基 : 電子対供与体
 ルイス酸
ルイス酸
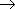 H3O+,
H+ + :NH3
H3O+,
H+ + :NH3 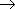 NH4+
NH4+
8.2.1 代表的なルイス酸 (塩基)
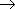 [Co(OH2)6]2+
[Co(OH2)6]2+
 電子供与 (F > Cl > Br)
で安定化
電子供与 (F > Cl > Br)
で安定化
 結合は第2周期で最も強い
結合は第2周期で最も強い
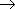 [BrF4]-
[BrF4]-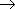 (CH3)2COI2
(CH3)2COI2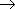 KOH + H2
KOH + H28.2.2 硬い/軟らかい 酸/塩基 (HSAB: Hard and Soft Acid and Base)
・平衡定数 K = [AB] / [A][B] から
| 塩基 B = X- に対する結合力 |
塩基 B = R2X, R3X に対する結合力 | |
| F- > Cl- > Br- > I- | 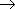 硬い酸 硬い酸 |
R2O >> R2S, R3N >> R3P |
| I- > Br- > Cl- > F- | 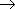 軟らかい酸 軟らかい酸 |
R3P >> R2S, R3N >> R2O |
| 硬い | 分極しにくい | 小さい |
|---|---|---|
| 軟らかい | 分極しやすい | 大きい |
・相互作用の性格
| 硬い−硬い | 軟らかい−軟らかい |
|---|---|
| クーロン引力 (イオン性) | 共有結合性 |
| 酸の LUMO 高 ・ 塩基の HOMO 低 | 酸の LUMO 低 ・ 塩基の HOMO 高 |
 |
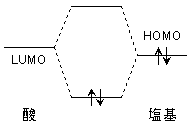 |