 電気・熱伝導性、光反射率、機械物性
電気・熱伝導性、光反射率、機械物性
<金属結合>
 電気・熱伝導性、光反射率、機械物性
電気・熱伝導性、光反射率、機械物性
<共有結合とイオン結合>
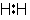 ,
, 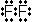 ,
,
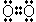 ,
, 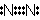 ,
,
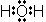
 + -
Cl
+ -
Cl -
-
| 指標 1 | 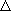 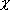 > 1.7 :
イオン性結合 > 1.7 :
イオン性結合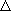 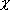 < 1.7 : 共有結合性 < 1.7 : 共有結合性
| |
| 指標 2 | イオン結合度 = 1 - exp[- 0.25(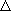 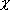 )2] )2] | |
4.1.1 最密充填構造
4.1.2 非最密充填構造
<配位数>
最密充填 12 体心立方 8
or 14 (6 個は距離が少し [約 15%] 遠い)単純立方 6 ダイアモンド構造 4
| hcp | Be, Cd, Co, Mg, Ti, Zn |
| fcc | Ag, Al, Au, Ca, Cu, Ni, Pb, Pt |
| bcc | Ba, Cr, Fe, W, アルカリ金属 |
<転位>
| 〜 906 ℃ |  -Fe (bcc) -Fe (bcc) |
| 906 〜 1401 ℃ |  -Fe (fcc) -Fe (fcc) |
| 1401 〜 1530 ℃ (m.p.) |  -Fe (bcc) -Fe (bcc) |
 -Fe(hcp) ... 高圧
-Fe(hcp) ... 高圧 ,
,  ,
,
 , ...
, ...
| 常温 |  -Sn -Sn(白色スズ) |
ダイアモンド変形構造 7.31g cm-3 |
| < 14.2 ℃ (slow) |
 -Sn -Sn(灰色スズ) |
ダイアモンド構造 5.75 g cm-3 |
4.3.1 半径比則
一般に 陰イオン > 陽イオン--- r+ / r- = 0.4 - 0.7 で配位数 6 をとる理由 ---
正八面体6配位間隙 (21/2 - 1) r- 〜 0.414 r -
立方体8配位間隙 (31/2 - 1) r- 〜 0.732 r -
0.414 < r+ / r- < 0.732陽イオンは陰イオンと接触
 半径比 0.611
半径比 0.611  正八面体6配位構造
正八面体6配位構造
4.3.2 代表的な結晶構造
・MX 型 (陽イオン : 陰イオン = 1 : 1)
| 結晶構造 | 配位数 | 基本骨格 | 代表例 |
| 1) 塩化セシウム (CsCl) 型 | 8 | bcc 各層に交互に M と X | CsBr, TlCl, NH4Cl |
| 2) 岩塩 (NaCl) 型 | 6 | X ccp の八面体間隙に M | AgF, MgO, CaS |
| 3) ヒ化ニッケル (NiAs) 型 | 6 | X hcp の八面体間隙に M | FeS, NiS |
| 4) 閃亜鉛鉱型 (ZnS) | 4 | X ccp の四面体間隙の半分に M | BeS, GaAs |
| 5) ウルツ鉱型 (ZnS) | 4 | X hcp の四面体間隙の半分に M | BeO, SiC, ZnO |
・MX2 型 (陽イオン : 陰イオン = 1 : 2)
| 結晶構造 | M 配 位数 |
X 配 位数 | 基本骨格 | 代表例 |
| 1) 蛍石 (CaF2) 型 | 8 | 4 | M ccp の四面体間隙に X | SrF2, BaCl2 |
| 1') 逆蛍石型 | 4 | 8 | X ccp の四面体間隙に M | Li2Te, Na2O |
| 2) ルチル (TiO2) 型 | 6 | 3 | X hcp の八面体間隙の半分に M | SnO2, MgF2 |
 から予想せよ。
から予想せよ。