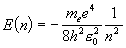(c) 2001 by Akira Miyoshi, All rights reserved.
[Top]
[はじめに]
[1章]
[2章]
[3章]
[4章]
[5章]
[6章]
[7章]
[8章]
[9章]
2001 物質化学(無機) - 1. 序論
1.序論
1.1 原子と構成原理
- 原子論 (Dalton, 1766-1844), 原子量 (Berzelius, 1779-1848)
- 経験的周期律 (Mendeleev, 1869)
- 原子核 (Rutherford, 1911), 原子番号=核の電荷 (Moseley, 1913)
原子構造論 (Bohr, 1913)
[資料 1.1, 1.2]
<構成原理> Aufbau principle / Building-Up Principle
- 原子=原子核+電子 核電荷=原子番号 原子核=陽子+中性子 (+中間子)
- 原子軌道 ( 主量子数 n, 方位量子数 l,
磁気量子数 ml )
[資料1.3]
n = 1, 2, 3, ... ( K 殻, L 殻, M 殻, N 殻, ... )
l = 0, ..., n - 1 ( s, p, d, f, ... 軌道 )
ml = -l, ..., 0, ... 1 ( 2l + 1通り )
軌道の名前:n [ l ] (1 s, 2s, 2p, 3s, 3p, 3d, ... )
縮退軌道 (n, l が同じ)
( px, py, pz / dxy,
dyx, dzx, dx2-y2,
dz2 / ... )
[資料1.4]
1軌道に最大2電子 (Pauliの排他律)
ms = -1/2, 1/2 (スピン量子数)
- 軌道に電子を詰める順序
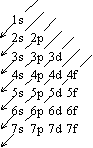
<電子配置>
ex.) He  1s2,
Li
1s2,
Li  1s22s1
= [He]2s1
1s22s1
= [He]2s1
[資料1.5]
<周期律>
・最外殻電子配置が等しい  性質類似
性質類似
[資料1.6]
- 短周期 (8元素) = n s (2), n p (6)
- 長周期 (18元素) = n s (2), (n - 1) d (10),
n p (6)
- ランタノイド、アクチノイド = (n - 2) f (14)
[問題1.1] 構成原理に基づいて以下の原子の電子配置を書け。
Ge, V, Sn
[問題1.2] 以下の元素の類似性を原子の電子配置を示した上で説明せよ。
F, Cl, Br, I
1.2 原子の輝線
<炎色反応>
ex.) Na ... 橙色 (トンネルの Na-lamp など)  ナトリウム D 線 (589 nm)
ナトリウム D 線 (589 nm)
(Na-lamp: 真空管に Na 蒸気[0.1〜1.5Pa]
を封入したもの)
励起状態 Na(2P) [doublet-P と読む]
電子配置:[Ne]3p1
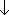 (発光) (吸収)
(発光) (吸収)
基底状態 Na(2S) [doublet-S と読む]
電子配置:[Ne]3s1
Fraunhofer (〜1814)
太陽光をプリズムで分光:暗線 (赤 青)
A, B, C, D, ...
青)
A, B, C, D, ...
( 一部 [Z,A,B] 地球大気の吸収。
他は太陽に存在する元素の吸収)
Kirchhoff (1824〜1887), Bunsen (1811〜1899)
実証的分光学 (cf. 原子吸光, ICP)
ex.) B線: O2 分子の吸収 / C, D, H 線:
H, Na, Ca 原子固有の吸収
H 原子発光系列: Balmer (1885), Lyman (1906), Paschen (1906)
Bohrの原子構造論 (1913)
[資料1.1, 1.2]
<Bohrモデル>
[資料1.1]
角運動量の量子化条件 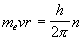 ,
n = 1, 2, 3, ...
,
n = 1, 2, 3, ...
(1.1)
軌道エネルギー 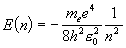
(1.2)
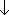
 1s2,
Li
1s2,
Li  1s22s1
= [He]2s1
1s22s1
= [He]2s1
 性質類似
性質類似
 ナトリウム D 線 (589 nm)
ナトリウム D 線 (589 nm)(発光) (吸収)
 青)
A, B, C, D, ...
青)
A, B, C, D, ...
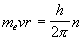 ,
n = 1, 2, 3, ...
,
n = 1, 2, 3, ...