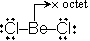 Be (価電子 2) Octet
を満たさない : 電子不足
Be (価電子 2) Octet
を満たさない : 電子不足
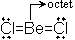
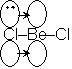
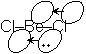 でやや安定化
でやや安定化
 分子間配位結合
分子間配位結合
 ポリマー (BeCl2)n
ポリマー (BeCl2)n
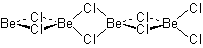
5.1.1 ルイス構造
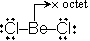 Be (価電子 2) Octet
を満たさない : 電子不足
Be (価電子 2) Octet
を満たさない : 電子不足
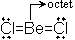
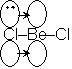
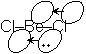 でやや安定化
でやや安定化
 分子間配位結合
分子間配位結合
 ポリマー (BeCl2)n
ポリマー (BeCl2)n
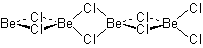
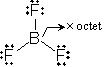
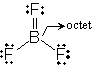 (分子内配位結合)
(分子内配位結合)
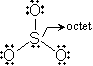
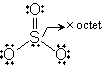
<共鳴>
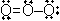
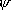 VB =
VB = 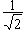 [
[ 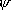 (O-O=O) +
(O-O=O) +
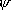 (O=O-O) ]
(O=O-O) ]
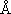 ( < rO-O [1.48
( < rO-O [1.48 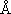 ],
> rO=O [1.21
],
> rO=O [1.21 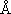 ] )
] )
ex.) BF3
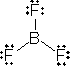
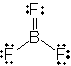
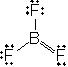
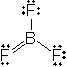
5.1.2 酸化数
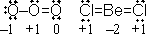
 負
負
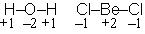
<超原子価化合物>
ex.) PCl5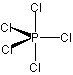 ,
SF6
,
SF6 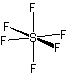
<混合原子価化合物>
ex.) Pb3O4 : 酸化数(Pb) = 8/3 ?
 (PbII2PbIV)O4
(PbII2PbIV)O4
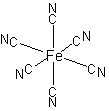 ,
3価サイト FeIII(NC)6
,
3価サイト FeIII(NC)6

| 原子価間遷移 | ...-CN-FeII-NC-FeIII-CN-...

...-CN-FeIII-NC-FeII-CN-...  e ---- e ----
|
| 原子価局在性 | 原子価遷移 | ex. | |
| クラス I : | 局在 | 紫外 | Pb3O4 |
| クラス II : | (中間) | 可視 | Eu3S4, CsAuCl3 |
| クラス III : | 非局在 | 可視〜近赤外 | Ag2F (金属性導体) |
5.1.3 結合エネルギー
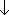 ... D
... D
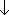 )
)
| D / kJ mol-1 | |
| C-C | 347 |
| Si-C | 301 |
| Ge-C | 242 |
| D / kJ mol-1 | D / kJ mol-1 | |||
| N-O | 163 | C-Cl | 326 | |
| P-O | 368 | Si-Cl | 401 | |
| As-O | 330 | Ge-Cl | 339 | |
| Sn-Cl | 314 |
s  |
pz  | |
 |
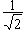 |
 |
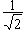 |
-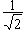 |
 |
s  |
px  |
py  | |
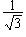 |
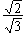 | 0 |  |
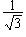 |
-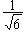 |
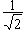 |
 |
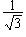 |
-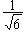 |
-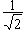 |
 |
5.2.1 対称操作・対称要素
| 記号 | 操作 | 対称要素 | 例 | |
| Cn | 回転 | n 回回転軸 | 軸周り角度 2 /
n 回転 /
n 回転 |
C2 (2回回転軸) ... H2O C3 (3回回転軸) ... NH3 C  (
( 回回転軸) ... CO 回回転軸) ... CO |
 | 鏡映 | 鏡面 | 鏡面に関する反射 v (垂直鏡面) : v (垂直鏡面) :Cn 軸を含む  h (水平鏡面) : h (水平鏡面) :Cn 軸に直交  d (二面鏡面) : d (二面鏡面) :nC2軸を2等分 |
 v ... H2O v ... H2O h ... BF3 h ... BF3
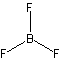  d ... Si2H6 d ... Si2H6
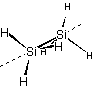 |
| i | 反転 | 対称心 | 対称中心に関する反転 | i (対称心) ... SF6 |
| Sn | 回映 | n 回回映軸 | Cn + 鏡映 (鏡面:回転軸に直交) |
S4 (4回回映軸) ... CH4 S6 (6回回映軸) ... Si2H6 |
 = S1,
i = S2 [資料 5.5]
= S1,
i = S2 [資料 5.5]5.2.2 分子の属する点群
 2つ以上..?-No
2つ以上..?-No  Cn?-Yes
Cn?-Yes  n 最大..?-No
n 最大..?-No 
 h?-No
h?-No
 n
n v?-Yes
v?-Yes
 Cnv [C2v]
Cnv [C2v]
 (同様)
(同様)
 [C3v]
[C3v]
| 点群 | 判定基準 | 例 |
C v v |
非対称直線分子 | CO, HCl, OCS |
D h h |
対称な直線分子 | CO2, H2, N2 |
| C1 | (対称要素なし) | CHBrClF 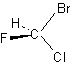 |
| Cs | 1 
 のみ のみ |
HOCl 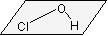 , NHF2 , NHF2
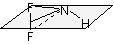 |
| Cn v | 1  Cn, n
Cn, n
 v v |
[C2v] : H2O, SO2Cl2
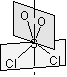 [C3v] : NH3, PCl3, POCl3 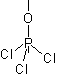 |
| Dn h | 1  Cn,
n Cn,
n  C2, C2,
 h, Sn h, Sn |
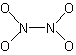
[D2h] : N2O4
 [D3h] : PCl5 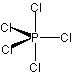 , BF3 , BF3
 |
5.2.3 対称性の応用
<極性>
<キラリティ>
 = S1, i =
S2 を含む) を持つ分子はキラルでない(アキラル)
= S1, i =
S2 を含む) を持つ分子はキラルでない(アキラル)
 面を持つ) ... アキラル /
H2O2 : C2
(C2 軸のみ) ... キラル
面を持つ) ... アキラル /
H2O2 : C2
(C2 軸のみ) ... キラル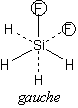 |
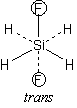 |
| SiH2F-SiH2F の gauche, trans 体 | |
お詫びと訂正
講義中、ゴーシュ (gauche) 配座の説明を、間違っていました。
正しくは右図のようになります。