 s, p, d, ... 軌道は縮退)
s, p, d, ... 軌道は縮退)
[資料2.3]
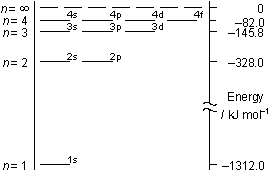
<Bohr軌道>
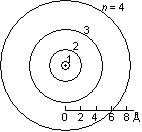
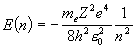
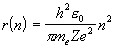
<水素原子類似軌道>
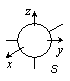
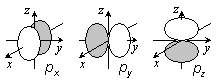
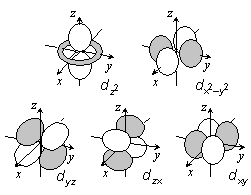
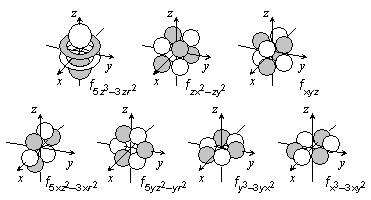
 s, p, d, ... 軌道は縮退)
s, p, d, ... 軌道は縮退)
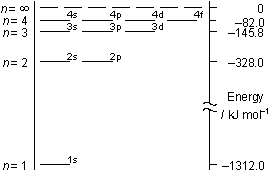
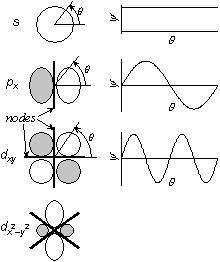
<軌道節面>
ex.)
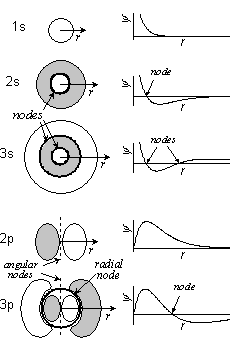
軌道 角度方向節 動径方向節 合計 1s 0 0 0 2s 0 1 1 2p 1 0 1 3s 0 2 2 3p 1 1 2 3d 2 0 2 cf.) (分子軌道でも一般に) 節の多い軌道ほどエネルギーが高い
節の数古典的周波数, (電子の運動周期)-1
E = h
cf.) 弦の振動
<遮蔽>
ex.) Li 原子 - 電子配置1s22s1 有効核電荷
(Zeff, Z * )
有効核電荷
(Zeff, Z * )
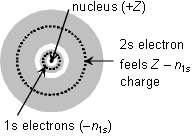
<Slaterの規則>
 遮蔽 1
遮蔽 1
<貫入>
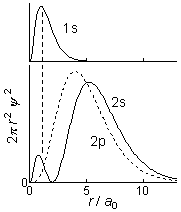
| 2s | 2p | |
| 動径節 | 1 (あり) | 0 (なし) |
| 1s 内側での存在確率 | 大 | 小 |
 [2p と比較して] 2s 軌道は:
[2p と比較して] 2s 軌道は:
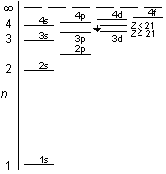
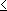 E(3d), etc.
E(3d), etc. 第4周期 4s2 の後に第1遷移金属周期
第4周期 4s2 の後に第1遷移金属周期
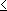 3d <
4p < 5s
3d <
4p < 5s 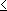 4d
4d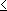 4f
4f 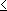 5d
< 6p < 7s
5d
< 6p < 7s 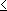 5f
5f  6d
6d 構成原理
("
構成原理
(" " の関係は微妙)
" の関係は微妙)2.2.1 原子価軌道
ex.) C 原子 - 原子価 = 4 (cf. オクテット則) 原子価軌道
原子価軌道2.2.2 原子価軌道の周期律
 |
Z * (有効核電荷) 
EORB (原子価 軌道エネルギー)  rORB (原子価 軌道の大きさ) 
|
 |
 rORB
rORB 
|
遷移周期中盤: 性質類似
 (旧 VIII 族に分類)
(旧 VIII 族に分類)
<不活性電子対効果>
「周期律表で遷移金属に続く典型元素が、しばしば小さい (価電子数-2) 酸化数をとること」 ("ns 電子対が不活性である" の意)
ex.) Sn ([Kr]5s24d105p2 価電子4) の2価化合物 : SnII (SnCl2) / TlI[解釈]
ns (n-1 の動径節)np (n-2 の動径節)
ns は np より (n-1)d に貫入遮蔽を受けにくい
内殻的・不活性
・第6周期: +(n-2)f の不完全遮蔽
さらに不活性
・13, 14族で顕著
16-17 族では np 自信の不完全遮蔽優勢顕著でなくなる