4f, 5f 軌道は遮蔽が非常に悪い  後続 d ブロック原子半径が収縮
後続 d ブロック原子半径が収縮
 ランタノイド収縮・アクチノイド収縮
ランタノイド収縮・アクチノイド収縮
ex.) 原子半径 / Å
| Sc 1.64 | Ti 1.47 | V 1.35 | Cr 1.29 |
| Y 1.82 | Zr 1.60 | Nb 1.47 | Mo 1.40 |
| Lu 1.72 | Hf 1.59 | Ta 1.47 | W 1.41 |
3.1.1原子半径の周期律 (cf. 2.2.2)
 ) ...
原子半径(
) ...
原子半径(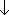 )
)
3.1.2ランタノイド収縮
4f, 5f 軌道は遮蔽が非常に悪い
後続 d ブロック原子半径が収縮
ランタノイド収縮・アクチノイド収縮
ex.) 原子半径 / Å
Sc 1.64 Ti 1.47 V 1.35 Cr 1.29 Y 1.82 Zr 1.60 Nb 1.47 Mo 1.40 Lu 1.72 Hf 1.59 Ta 1.47 W 1.41
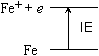
| ex.) | Fe  Fe+ + e
Fe+ + e |
(第1) イオン化エネルギー |
Fe+  Fe2+ + e
Fe2+ + e |
第2イオン化エネルギー | |
Fe2+  Fe3+ + e
Fe3+ + e |
第3イオン化エネルギー |
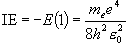 (= 1312 kJ
mol-1)
(= 1312 kJ
mol-1)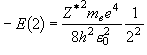 = 537 kJ
mol-1
= 537 kJ
mol-13.2.1 フロンティア軌道
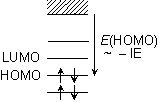
3.2.2 イオン化エネルギーの周期性
 ) -
IE(
) -
IE( ) ... 不完全遮蔽の蓄積
) ... 不完全遮蔽の蓄積
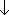 ) -
IE(
) -
IE( ) ...
原子価軌道の主量子数
) ...
原子価軌道の主量子数 (第2
(第2 3周期で明瞭)
3周期で明瞭)
| 1) | 2  13族 13族 |
Be  B, B,Mg  Al, Al,... |
[HOMOが] ns  np np |
| 2) | 12  13族 13族 |
Zn  Ga, Ga,Cd  In, In,... |
[HOMOが] (n-1)d  np np |
| 3) | 15  16族 16族 |
N  O, O,P  S, S,... |
「半副殻」は安定 (交換エネルギー,電子間反発) |
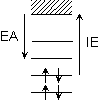
| ex.) | Cl + e
 Cl- Cl- | [EA > 0] | 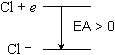 |
Ar + e  Ar-
Ar- | [EA < 0] | 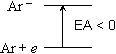 |
 )
・化合物中の原子が電子を引付ける傾向の目安
)
・化合物中の原子が電子を引付ける傾向の目安
Mullikenの電気陰性度 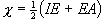
Paulingの電気陰性度 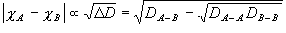
 +
- B
+
- B -) ...
-) ...
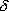 2
2 (
( D:
結合エネルギーのイオン結合分)1/2
D:
結合エネルギーのイオン結合分)1/2
 A, B の電気陰性度の差
A, B の電気陰性度の差
Allred-Rochowの電気陰性度  = 0.744 + 0.359 Z * / r 2
= 0.744 + 0.359 Z * / r 2
 軌道半径
軌道半径 クーロン力)
クーロン力)
3.4.1 電気陰性度の周期性
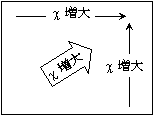
3.4.2 単体の性質と電気陰性度
| 小 |  |
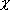 |
 | 大 |
| 金属 | 亜金属(半導体)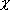 (Pauling) (Pauling)= 1.9〜2.2 |
共有結合分子 | ||
| M 金属 |
 |
sM 亜金属 |
 |
ps ポリマー固体 |
 |
ms 分子固体 |
 |
l 液体 |
 |
g 気体 |
| 1 族 | 2 族 | 13 族 | 14 族 | 15 族 | 16 族 | 17 族 | 18 族 |
| アルカリ 金属 | アルカリ 土類 |
土類 | 炭素族 | 窒素族 | 酸素族 | ハロゲン | 希ガス |
| Li (M) | Be (M) | B (ps) | C (ps) | N2 (g) | O2 (g) | F2 (g) | Ne (g) |
| M | Al (M) | Si (sM) | P4 (ms) | S8 (ms) | Cl2 (g) | Ar (g) | |
| Ga (M) | Ge (sM) | As (ps) | Se8 (ms) | Br2 (l) | Kr (g) | ||
| In (M) | Sn (M) | Sb (sM) | Te (sM) | I2 (ms) | Xe (g) | ||
| Tl (M) | Pb (M) | Bi (M) | |||||
<対角関係>
・周期律表対角 (左上-右下) にある元素は、電気陰性度が近く性質類似
<同素体>
・中間的な 
 多種の同素体
多種の同素体
ex.) B12 [資料 3.6], P4, P(polymer) [3.7],
C(diamond), C(graphite) [3.8]