 NA or
k
NA or
k  R
R
 NA or
k
NA or
k  R
R
 2P 平衡定数
2P 平衡定数 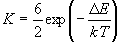
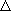 E =
E =
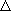 E - T (k ln3)
E - T (k ln3)
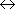 -kT lnK =
-kT lnK =
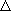 G =
G =  H
- T
H
- T  S )
S )
 H =
H =
 E,
E, 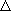 S =
k ln3
S =
k ln3
 |
| 図 9.1 内部エネルギーの基準 |
9.1 内部エネルギー
[内部エネルギー]
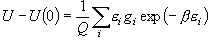
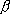 = 1 / kT
= 1 / kT
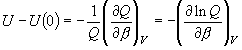 (9.1)
(9.1)
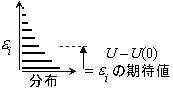 |
| 図 9.2 内部エネルギー |
分子運動からの寄与
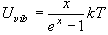 (9.2)
(9.2)
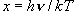
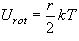 (9.3)
(9.3)
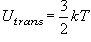 (9.4)
(9.4)
 10-6 cm-1 = 9.3
10-6 cm-1 = 9.3  10-8 kJ mol-1
10-8 kJ mol-1
[定容熱容量]
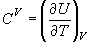 (9.5)
(9.5)
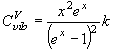 (9.6)
(9.6)
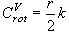 (9.7)
(9.7)
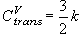 (9.8)
(9.8)
9.2 エントロピー
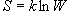 (9.9)
(9.9)
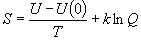 (9.10)
(9.10)
分子運動からの寄与
![S_{vib} = \left[ {\frac{x}{{e^x - 1}} - \ln \left( {1 - e^{ - x} }
\right)} \right]k](eqn/eq0911.gif) (9.11)
(9.11)
![S_{rot} = \left[ {\ln \frac{{\Gamma \left( r \right)\Gamma
\left( {r/2} \right)}}{\sigma } + \frac{r}{2}\left( {1 +
\ln \frac{{kT}}{{B_{av} }}} \right)} \right]k](eqn/eq0912.gif) (9.12)
(9.12)
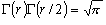 (r = 1, 3),
(r = 1, 3), 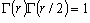 (r = 2)
(r = 2)
![S_{trans} = \left[ {\frac{5}{2} + \frac{3}{2}\ln \frac{{2\pi
mkT}}{{h^2 }} + \ln V} \right]k](eqn/eq0913.gif) (9.13)
(9.13)
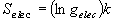 (9.14)
(9.14)
 10-7, Svib (I2) =
8.4 [J K-1 mol-1]
10-7, Svib (I2) =
8.4 [J K-1 mol-1]
9.3 他の熱力学関数
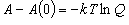 (9.15)
(9.15)
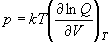 (9.16)
(9.16)
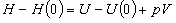
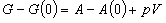
[完全気体]
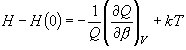 (9.17)
(9.17)
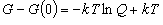 (9.18)
(9.18)
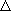 H / kT = H / kT = |
+ 51.96 [ 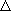 U (0) = U (0) =
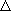 E ] E ] |
- 0.015 [Uvib ] |
- 1 [Urot ] |
+ 1.5 [Utrans ] |
+ 1 [pV = kT ] |
= 53.44 | |
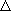 S / k = S / k = | -0.018 [Svib ] |
- 2.77 [Srot ] |
+ 15.08 [Strans ] |
+ 1.39 [Selec ] |
= 13.68 |
-lnKp =
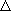 G / kT =
G / kT =
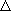 H / kT -
H / kT -
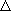 S / k = 39.76
S / k = 39.76
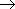 Kp = exp(-39.76)
= 5.40
Kp = exp(-39.76)
= 5.40  10-18 [atm]
10-18 [atm]
Kc = Kp / RT =
39.6 molecules cm-3
( R = 1.3626  10-22 atm
K-1 cm3 molecule-1 )
10-22 atm
K-1 cm3 molecule-1 )
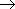 HCl + H
の振動・回転・相対並進・電子状態の 298 K における、
エントロピー変化を以下の情報から計算せよ。
HCl + H
の振動・回転・相対並進・電子状態の 298 K における、
エントロピー変化を以下の情報から計算せよ。| Cl | H2 | HCl | H | |
振動波数 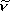 [cm-1]
[cm-1] |
4162 | 2886 | ||
| 回転定数 B [cm-1] | 59.3 | 10.4 | ||
回転対称数 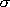 |
2 | 1 | ||
| 質量 m [amu] | 35 | 2 | 36 | 1 |
| 電子状態の多重度 | 4 | 1 | 1 | 2 |
| Cl | H2 | HCl | H | |
 Hf Hf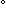 (298 K) [kJ mol-1]
(298 K) [kJ mol-1] |
121.3 | 0 | -92.3 | 218.0 |