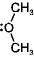(c) 2000 by A. Miyoshi, Univ. Tokyo
All rights reserved.
[Top]
[はじめに]
[1章]
[2章]
[3章]
[4章]
[5章]
[6章]
[7章]
[8章]
[9章]
2000 物質化学(無機) -
8. 酸と塩基
8.酸と塩基
8.1 ブレンステッド酸・塩基
酸:プロトン (H+) 供与体
 塩基:プロトン受容体
塩基:プロトン受容体
8.1.1 共役酸・共役塩基
| 酸1 | | 塩基2 | | 共役塩基1 | | 共役酸2
|
HCl
| +
| H2O
|  
| Cl-
| +
| H3O+
| (8.1)
|
・Cl- は HCl の共役塩基、
H3O+ は H2O の共役酸
・酸 HCl はプロトンを放出して共役塩基 Cl- になる
|
|
|
H2O
| +
| NH3
|  
| OH-
| +
| NH4+
| (8.2)
|
| ・塩基 NH3 はプロトンを受容して共役酸
NH4+ になる
|
[問題 8.1] 以下の反応の酸・塩基、及びそれぞれの共役酸・塩基は何か
1) PO43- + H2O
 HPO42- + OH-
HPO42- + OH-
2) HNO3 + H2O
 H3O+
+ NO3-
H3O+
+ NO3-
8.1.2 酸性度定数
| (8.1) | Ka =
[H3O+][Cl-] / [HCl]
| pKa = - log10 Ka
|
| (8.2) | Kb =
[NH4+][OH-] / [NH3]
| pKb = - log10 Kb
|
- pKa < 0 : 強酸、
pKa > 0 : 弱酸
[資料 8.1]
8.1.3 酸性度の規則性
<水素酸>
<水和酸化物>
<オキソ酸>
[資料 8.3]
<無水酸化物>
- 酸性酸化物 : 水に溶解してプロトンを放出する酸化物
ex.) CO2 + H2O  H2CO3
H2CO3
(+H2O)  H3O+ +
HCO3-
H3O+ +
HCO3-
(+H2O)  H3O+ +
CO32-
H3O+ +
CO32-
- 塩基性酸化物 : 水に溶解してプロトンを受容する酸化物
ex.) CaO + 2 H3O+
 Ca2+ + 3 H2O
Ca2+ + 3 H2O
- 両性酸化物 : 酸・塩基いずれとも反応する酸化物
ex.) Al2O3 +
6 H3O+ + 3 H2O
 2 [Al(OH2)6]3+
2 [Al(OH2)6]3+
Al2O3 + 2 OH- +
3 H2O  2
[Al(OH)4]-
2
[Al(OH)4]-
- 酸化物が両性 : 金属-非金属の境界領域で見られる
(
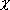 と強く関連)
と強く関連)
[資料 8.5]
- 酸化数で酸性・塩基性が変化
[資料 8.6]
[問題 8.2] 亜塩素酸 (HOClO) と過塩素酸 (HOClO3)
はどちらが強い酸か? 理由を示して答えよ。
[問題 8.3] Pauling 則により、H3PO4
の逐次解離定数 (Ka1, Ka2,
Ka3) を推定せよ。
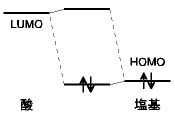
8.2 ルイス酸・塩基
酸:電子対受容体  塩基:電子対供与体
塩基:電子対供与体
H+ (プロトン) は電子対を受容するので、ルイス酸
ex.) H+ + :OH2
 H3O+,
H+ + :NH3
H3O+,
H+ + :NH3  NH4+
NH4+
(ブレンステッド酸はルイス酸性を示す)
8.2.1 代表的なルイス酸(塩基)
- 金属イオン(酸)と配位子(塩基)
(錯体の形成)
ex.) Co2+ + 6 H2O
 [Co(OH2)6]2+
[Co(OH2)6]2+
ex.) Ag+ + C6H6
(benzene)  [C6H6Ag]+
[C6H6Ag]+
- Octet を満たさない原子の空軌道(酸)
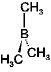
<BX3>
<AlX3>
AlCl3: 気相では2量体 (分子間配位)
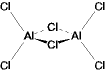
Friedel-Crafts 反応の Lewis 酸触媒
[資料8.8]
- 大きくOctet拡張可能な原子(酸)
- 低い反結合性空軌道を持つ分子(酸)
ex.) I2(s) + I-(aq)
 I3-(aq)
I3-(aq)
ex.) (CH3)2CO +
Br2  (CH3)2COBr2
(CH3)2COBr2
[問題 8.4] 以下の反応における酸と塩基を判別せよ
1) BrF3 + F-  [BrF4]-
[BrF4]-
2) (CH3)2CO + I2
 (CH3)2COI2
(CH3)2COI2
3) KH + H2O  KOH + H2
KOH + H2
[問題 8.5] BF3, BCl3, BBr3
をルイス酸性の順に並べ、その理由を説明せよ。
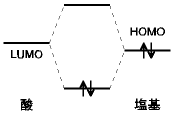
8.2.2 典型的な酸-塩基反応
- 錯体形成反応
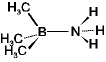
ex.) (CH3)3B + :NH3
 (CH3)3B-NH3
(CH3)3B-NH3
<配位結合> (右図)
- 置換反応
ex.) 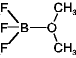 +
+
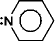

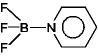 +
+
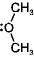
- 交換反応 (Metathesis Reaction)
ex.) (H3C)3Si-I + AgBr(s)
 (H3C)3Si-Br
+ AgI(s)
(H3C)3Si-Br
+ AgI(s)
8.2.3 ルイス酸・塩基強度の規則性
<置換基効果>
| ex.) | 塩基性 :
| (CH3)3N > H3N
> F3N
|
| 酸性 : | (CH3)3B <
H3B < F3B
|
| 電子供与性置換基 :
| 塩基性
| 酸性
|
| 電子吸引性置換基 :
| 塩基性
| 酸性
|
cf.) BF3, BCl3, BBr3
の順序関係は逆 (8.2.1)
<硬い/軟らかい-酸/塩基 (HSAB: Hard and Soft Acid and Base)>
















 HPO42- + OH-
HPO42- + OH- 小
小
 =
z 2 / (r+ + d) と
pKa が相関
=
z 2 / (r+ + d) と
pKa が相関
 +
+
 電子供与は F > Cl > Br
の順に強く、BF3 は最もルイス酸性が弱い
電子供与は F > Cl > Br
の順に強く、BF3 は最もルイス酸性が弱い

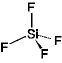 + 2 F-
+ 2 F- 

 +
+

 +
+