(c) 2000 by A. Miyoshi, Univ. Tokyo
All rights reserved.
[Top]
[はじめに]
[1章]
[2章]
[3章]
[4章]
[5章]
[6章]
[7章]
[8章]
[9章]
2000 物質化学(無機) -
5. 分子構造と結合
5.分子構造と結合
5.1 古典結合概念
5.1.1 ルイス構造
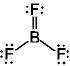
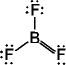
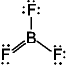
ここでは Lewis 構造の書き難いもののみを示す
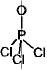
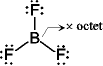
[問題 5.1] SiO2, NF3,
(BeCl2)n, BCl3,
SO42- のルイス構造を書け。
<共鳴>
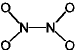
[問題 5.2] CO32-, SO32-,
SO42- の局在構造を書け。
5.1.2 酸化数
<形式電荷>
共有結合性を強調した電荷
中性原子の価電子数 - ルイス構造の原子価
ex.) 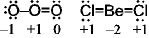
<酸化数>
イオン結合性を強調した電荷
電気陰性度大
 負
負
ex.) 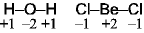
[問題 5.3] SiO2, NF3, NH3
分子のそれぞれの原子の酸化数を書け。
<超原子価化合物>
ex.) PCl5
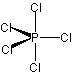 SF6
SF6 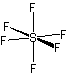
<混合原子価化合物>
ex.) Pb3O4 : 酸化数(Pb) = 8/3 ?
 (PbII2PbIV)O4
(PbII2PbIV)O4
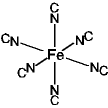
ex.) プルシアンブルー
(FeIII4
[FeII(CN)6]3) 構造 光機能性材料
2価サイト FeII(CN)6
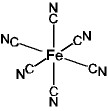 3価サイト FeIII(NC)6
3価サイト FeIII(NC)6
| 原子価間遷移
| ...-CN-FeII-NC-FeIII-CN-...
...-CN-FeIII-NC-FeII-CN-...
 e ---- e ----
|
[Robin-Day の分類]
| 原子価局在性 | 原子価遷移 | ex.
|
| クラスI: | 局在 | 紫外 | Pb3O4
|
| クラスII: | (中間) | 可視
| Eu3S4, CsAuCl3
|
| クラスIII: | 非局在 | 可視〜近赤外
| Ag2F (金属性導体)
|
5.1.3結合エネルギー
孤立電子対なし (周期律表  ... D
... D 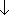 )
)
大きな軌道ほど軌道の overlap がわるい
| D / kJ mol-1
|
| C-C | 347
|
| Si-C | 301
|
| Ge-C | 242
|
孤立電子対あり
第2周期で孤立電子対の反発
| D / kJ mol-1
| | | D / kJ mol-1
|
| N-O | 163 | C-Cl | 326
|
| P-O | 368 | Si-Cl | 401
|
| As-O | 330 | Ge-Cl | 339
|
| | Sn-Cl | 314
|
- 二重結合 : 軌道 overlap のよい第2周期で強い
[問題 5.4]
a) N-N 単結合 (163 kJ mol-1) は P-P 単結合
(201 kJ mol-1) より弱い理由を考えよ。
b) 窒素とリンの代表的な単体の構造の違いを示し、
その理由を説明せよ。
5.1.4 混成軌道
共鳴同様VB法で発展 :
MO 法では必要はないが理解の方法としては有用
<sp 混成>
<sp2 混成>
ex.) PCl5 の面内の結合
cf. PCl5 の上下 (z 軸) 方向の結合 :
3中心4電子結合
5.2 分子の対称性
5.2.1 対称操作・対称要素
| 記号 | 操作 | 対称要素 | | 例
|
| Cn | 回転
| n 回回転軸 | 軸周り角度
2 / n 回転 / n 回転
| C2 (2回回転軸) ...
H2O [資料 5.1a]
C3 (3回回転軸) ...
NH3 [資料 5.1b]
C (
( 回回転軸) ... CO 回回転軸) ... CO
|

| 鏡映 | 鏡面 | 鏡面に
関する反射
|  v
(垂直鏡面) ... H2O [資料 5.2] v
(垂直鏡面) ... H2O [資料 5.2]
 h
(水平鏡面) ... BF3 h
(水平鏡面) ... BF3
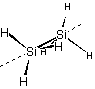
 d
(二面鏡面) ... Si2H6 d
(二面鏡面) ... Si2H6
|
| i | 反転 | 対称心
| 対称中心に
関する反転 | i
(対称心) ... SF6 [資料 5.3]
|
| Sn | 回映
| n 回回映軸 | Cn
+ 鏡映
(鏡面:回転軸に直交)
| S4 (4回回映軸) ...
CH4 [資料 5.4]
S6 (6回回映軸) ...
Si2H6
|
*注 :  = S1,
i = S2 [資料 5.5]
= S1,
i = S2 [資料 5.5]
5.2.2 分子の属する点群
・分子の持つ対称要素から決まる
判別 chart : [資料 5.6]
・典型的な点群
[資料 5.7]
[以下は理解せよ!]
| 点群 | 判定基準 | 例
|
C v v
| 非対称直線分子 | CO, HCl, OCS
|
D h h
| 対称な直線分子 | CO2, H2,
N2
|
| C1 | (対称要素なし) | CHBrClF
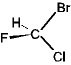
|
| Cs | 1  のみ のみ | HOCl
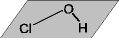 ,
NHF2 ,
NHF2
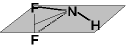
|
| Cnv
| 1 Cn,
n Cn,
n  v v
| [C2v]: H2O,
SO2Cl2
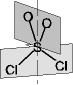
[C3v]: NH3, PCl3,
POCl3
|
| Dnh
| 1 Cn,
n Cn,
n C2, C2,
 h,
Sn h,
Sn
| [D2h]: N2O4
[D3h]: PCl5
 , BF3 , BF3

|
[問題 5.5] 以下の分子が属する点群を書け。
BeCl2, O3, PFCl2, NHFCl, HCN,
C2H4
5.2.3 対称性の応用
<極性>
以下の場合分子は極性 ( = 永久双極子を持つ) ではない
- i を持つか、正多面体(Td,
Oh, Ih)
- Dn または Dnh 点群
<キラリティ>
キラル = 鏡像異性体の存在する
- 回映軸 (
 = S1, i = S2 を含む)
を持つ分子はキラルでない(アキラル)
= S1, i = S2 を含む)
を持つ分子はキラルでない(アキラル)
- キラルな分子は回転軸のみを持ちうる
ex.) SiH2FCl:Cs
( 面を持つ) ... アキラル /
H2O2:C2
(C2 軸のみ) ... キラル
面を持つ) ... アキラル /
H2O2:C2
(C2 軸のみ) ... キラル
[問題 5.6] 以下の分子はキラルかアキラルか?
PHFCl, gauche-SiH2F-SiH2F, HOCl
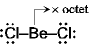 Be(価電子2) Octet
を満たさない:電子不足
Be(価電子2) Octet
を満たさない:電子不足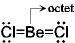
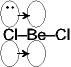
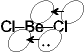 でやや安定化
でやや安定化 分子間配位結合
分子間配位結合 ポリマー
(BeCl2)n
ポリマー
(BeCl2)n
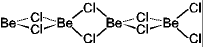
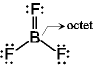 (分子内配位結合)
(分子内配位結合)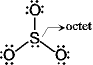
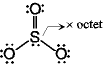 !結合は単結合よりも短い
!結合は単結合よりも短い
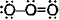

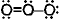
 VB
=
VB
=  [
[
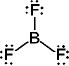
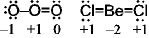
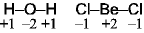
 SF6
SF6 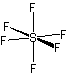
 3価サイト FeIII(NC)6
3価サイト FeIII(NC)6

 e ----
e ----
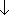 ... D
... D 

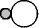


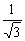
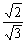

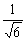

 / n 回転
/ n 回転
 (
( 回回転軸) ... CO
回回転軸) ... CO





 ,
NHF2
,
NHF2



