 2),
H の 1s
2),
H の 1s  3つの分子軌道
3つの分子軌道
 計 2 個の電子
計 2 個の電子[3中心(軌道 or 原子)2電子]
cf.) 末端 B-H : 通常の2中心2電子結合 [結合次数 1 ]
<3中心2電子結合>
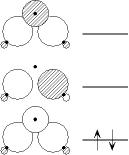 ex.) B2H6
ex.) B2H6
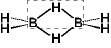 の橋架け部 (B-H-B) の部分分子軌道
の橋架け部 (B-H-B) の部分分子軌道
 2),
H の 1s
2),
H の 1s  3つの分子軌道
3つの分子軌道
 計 2 個の電子
計 2 個の電子<3中心4電子結合>
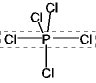
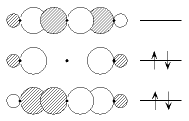 ex.) PCl5
ex.) PCl5
 の面外 Cl-P-Cl の部分分子軌道
の面外 Cl-P-Cl の部分分子軌道
 2)
2)
 3つの MO
3つの MO
 計 4 個の電子
計 4 個の電子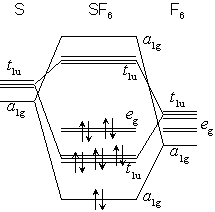
ex.) PCl5, SF6
古典解釈 :
部分 MO 法 (3中心4電子結合) :
<SF6 の MO>
1a1g2(結合性)
1t1u6(結合性)
eg4(非結合性)
結合次数 : 4(1つの S-F あたり 2/3)
・複数の「結合」に非局在化した MO
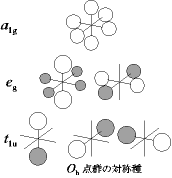
・a1g, eg,
t1u など ... Oh 点群の対称種
cf.)  g,
g,
 u,
u,
 g など ...
D
g など ...
D h 点群の対称種
h 点群の対称種
第2周期元素の XH2 分子
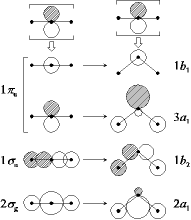
<分子軌道>
 OH2(屈曲) の分子軌道
OH2(屈曲) の分子軌道
| 軌道 エネルギー (直線  屈曲) 屈曲)
| ||||
1 u u
| 
| 1b1 | 非結合性 | 
|

| 3a1 | 非結合性 | 
| |
1 u u
| 
| 1b2 | 結合性 | 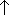
|
2 g g
| 
| 2a1 | 結合性 | 
|
<Walsh 則>
 u -
1b2 のエネルギーが極小となる直線構造
u -
1b2 のエネルギーが極小となる直線構造
 u -
3a1 のエネルギーの低下が大きいので屈曲構造
u -
3a1 のエネルギーの低下が大きいので屈曲構造
| BeH2 | BH2 | CH2 | NH2 | OH2 | |
| 価電子数 | 4 | 5 | 6 | 7 | 8 |
| 結合角 (°) | 180 | 131 | 136 | 103 | 105 |
<バンド>
| 2個の AO の相互作用 | 
| 2個の MO | 
|
| 3個の AO の相互作用 | 
| 3個の MO | 
|
| n 個の AO の相互作用 | 
| n 個の MO | 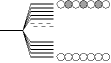
|
 個の AO の相互作用 個の AO の相互作用
| 
|  個の MO 個の MO
| 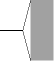 バンド バンド
|
 s バンド,
p 軌道
s バンド,
p 軌道  p バンド
p バンド
<フェルミ (Fermi) 準位>
<金属の原子化エンタルピー>
<電気伝導度>
 =
=
 0
exp(- Eg / 2kT)
0
exp(- Eg / 2kT)
 1/
1/ )
の温度依存性を測定したら、以下のようになった。
)
の温度依存性を測定したら、以下のようになった。| 温度 / K | 313 | 425 |
抵抗 / 
| 11.8 | 0.35 |
| 物質 | C (ダイアモンド) | Si | Ge | GaAs | InAs |
| バンドギャップ / eV | 5.47 | 1.12 | 0.66 | 1.42 | 0.36 |