4f, 5f 軌道は遮蔽が非常に悪い  後続 d ブロック原子半径が収縮
後続 d ブロック原子半径が収縮
 ランタノイド収縮・アクチノイド収縮
ランタノイド収縮・アクチノイド収縮
ex.) 原子半径 / Å
| Sc 1.64 | Ti 1.47 | V 1.35 | Cr 1.29 |
| Y 1.82 | Zr 1.60 | Nb 1.47 | Mo 1.40 |
| Lu 1.72 | Hf 1.59 | Ta 1.47 | W 1.41 |
3.1.1原子半径の周期律 (cf. 2.2.2)
 ) ...
原子半径(
) ...
原子半径( )
)
3.1.2ランタノイド収縮
4f, 5f 軌道は遮蔽が非常に悪い
後続 d ブロック原子半径が収縮
ランタノイド収縮・アクチノイド収縮
ex.) 原子半径 / Å
Sc 1.64 Ti 1.47 V 1.35 Cr 1.29 Y 1.82 Zr 1.60 Nb 1.47 Mo 1.40 Lu 1.72 Hf 1.59 Ta 1.47 W 1.41
| ex.) | Fe  Fe+ + e
Fe+ + e
| (第1) イオン化エネルギー |
Fe+  Fe2+ + e
Fe2+ + e
| 第2イオン化エネルギー | |
Fe2+  Fe3+ + e
Fe3+ + e
| 第3イオン化エネルギー |
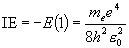 (= 1312 kJ
mol-1)
(= 1312 kJ
mol-1)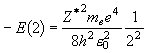 = 537 kJ
mol-1
= 537 kJ
mol-13.2.1 フロンティア軌道
3.2.2 イオン化エネルギーの周期性
 ) -
IE(
) -
IE( ) ... 不完全遮蔽の蓄積
) ... 不完全遮蔽の蓄積
 ) -
IE(
) -
IE( ) ...
原子価軌道の主量子数
) ...
原子価軌道の主量子数 (第2
(第2 3周期で明瞭)
3周期で明瞭)
 13族
(Be
13族
(Be B,
Mg
B,
Mg Al, ...)
Al, ...) np
np
 13族
(Zn
13族
(Zn Ga,
Cd
Ga,
Cd In, ...)
In, ...) np
np
 16族
(N
16族
(N O,
P
O,
P S, ...)
S, ...)| ex.) | Cl + e
 Cl- Cl- | [EA > 0] |
Ar + e  Ar-
Ar- | [EA < 0] |
 )
)
・化合物中の原子が電子を引付ける傾向の目安
Mullikenの電気陰性度 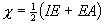
Paulingの電気陰性度 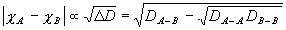
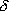 +
- B
+
- B -)
-) (
( D:
結合エネルギーのイオン結合分)1/2
D:
結合エネルギーのイオン結合分)1/2
 A, B の電気陰性度の差
A, B の電気陰性度の差
Allred-Rochowの電気陰性度 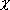 = 0.744 + 0.359 Z* / r 2
= 0.744 + 0.359 Z* / r 2
 軌道半径
軌道半径 クーロン力)
クーロン力)
3.4.1 電気陰性度の周期性
3.4.2 単体の性質と電気陰性度
| 小 | 
| 
|  | 大 |
| 金属 | 亜金属(半導体) (Pauling) (Pauling)= 1.9〜2.2 | 共有結合分子 | ||
M  金属 | sM  亜金属 | ps  ポリマー固体 | ms  分子固体 | l  液体 | g  気体 |
| 1 族 | 2 族 | 13 族 | 14 族 | 15 族 | 16 族 | 17 族 | 18 族 |
| アルカリ 金属 | アルカリ 土類 | 土類 | 炭素族 | 窒素族 | 酸素族 | ハロゲン | 希ガス |
| Li (M) | Be (M) | B (ps) | C (ps) | N2 (g) | O2 (g) | F2 (g) | Ne (g) |
| M | Al (M) | Si (sM) | P4 (ms) | S8 (ms) | Cl2 (g) | Ar (g) | |
| Ga (M) | Ge (sM) | As (ps) | Se8 (ms) | Br2 (l) | Kr (g) | ||
| In (M) | Sn (M) | Sb (sM) | Te (sM) | I2 (ms) | Xe (g) | ||
| Tl (M) | Pb (M) | Bi (M) | |||||
<対角関係>
・周期律表対角 (左上-右下) にある元素は、電気陰性度が近く性質類似<同素体>
・中間的な
 多種の同素体
多種の同素体