概要
 |
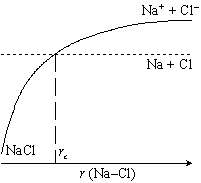
| 図 1-2. 「もりうち」機構 |
衝突理論 (アトキンス 27.1 章 [第4版では 28.1 章]) の演習問題。
分子直径と平均並進速度のみから導かれる単純衝突理論は、
分子を硬い球であると近似したもので 「剛体球衝突理論」
とも呼ばれる。
衝突理論のよく知られている応用は、
気体の移動速度論などで使われる
「平均自由行程」 の推算である。 気相の化学反応は、
分子衝突が起こらなければ起こらないので、 衝突速度は反応速度の
上限値であると考えることができる。
この演習で扱う 「もりうち機構」 の反応は、 ある限界距離
rc 以下に Na と Cl
が近づくと引力が働いて反応が起こる (図 1-2)、 というもので、
剛体衝突理論と同じ理論式で、 反応速度定数が記述される。
一般的には 「もりうち機構」 は定性的な説明であって、
反応速度定数の、 定量的な推定や議論に耐えるものではない。
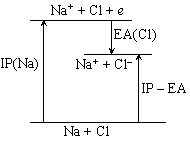 |
| 図 1-3. IP - EA |
補足説明と演習のヒント
・(1-2) 式の IP - EA は Na + Cl と Na+ + Cl- のエネルギー差に相当する (反応 R1 の場合) (図 1-3 参照)。
・(1-2) 式の最後の項はクーロン引力で、ここでは SI 単位系での式を示した。
分母の 4
 0
がない式を目にすることがあるが、これは cgs-esu 単位系の式である。
SI 単位で計算する場合は、 分母の
4
0
がない式を目にすることがあるが、これは cgs-esu 単位系の式である。
SI 単位で計算する場合は、 分母の
4
 0
を忘れてはならない。
0
を忘れてはならない。
・物理量は最も一般的に用いられる単位で示したため、 単位の換算が必要である。 以下を参照せよ。
 1 [V] =
e [J] = 1.6022
1 [V] =
e [J] = 1.6022  10-19 [J]
10-19 [J]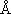 = 10-10 m =
10-8 cm
= 10-10 m =
10-8 cm
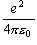 [C2
F-1 m = J m] =
[C2
F-1 m = J m] = 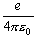 [eV m] = 14 〜 15 [eV
[eV m] = 14 〜 15 [eV  ]
]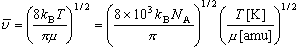
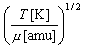 [m s-1]
[m s-1]・反応 (R2) に関しても、考え方は反応 (R1) と同様。 生成物が NaCl2 ではなく、 NaCl + Cl となっているが、 反応速度定数は Na と Cl2 が近づくところで決定される。 (図 1-4 参照)
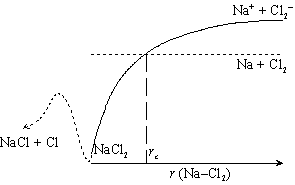 |
| 図 1-4. 反応 (R2) |
・答の値は、反応 (R1), (R2) とも以下の範囲にある。
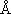
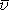 = 100 〜 1000
m s-1
= 100 〜 1000
m s-1