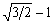
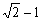
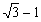
1998-2000 年度の試験問題を公開しています。 講義内容は年度によって少しづつ異なりますので、過去の問題の中には 2001 年度の講義では触れない部分も若干含まれています。
| 科目名 物質化学(無機系化合物) |
教官名 三好 明 |
7月26日2時限 試験時間90分 |
|
| 指定クラス 2年理1 (01-09, 26-27) 2年理23 (06, 08-09) |
解答用紙 両面2枚 |
計算用紙 なし |
持ち込み 不可 |
物質化学(無機系化合物)試験問題
以下の問に答えよ。必要に応じて図表を参照せよ。
(試験中は問題に関する質問は一切受け付けない)
| 正多面体 | 半径 | |
| 正四面体 | 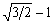 |
〜0.225 |
| 正八面体 | 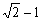 |
〜0.414 |
| 立方体 | 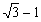 |
〜0.732 |
問 1. 以下の原子またはイオンの基底状態の電子配置を書け。
a) P, b) Y, c) Cr3+,
d) Na+
問 2. H-Cl, Na-Cl 結合はどちらがイオン結合性が強いか? 根拠を示して答えよ。
問 3. 右の表 1 は、半径 1 の球で構成される正多面体間隙にちょうど入る
球の半径を示したものである。イオン半径 r (Na+) = 0.96
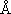 , r (Cs+) = 1.69
, r (Cs+) = 1.69
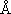 , r (Cl-) = 1.81
, r (Cl-) = 1.81
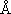 から、a) NaCl, b) CsCl 結晶の
(1)正イオンに対する陰イオンの配位数 (2)構造 を予想せよ。
結晶構造は陰イオンを
から、a) NaCl, b) CsCl 結晶の
(1)正イオンに対する陰イオンの配位数 (2)構造 を予想せよ。
結晶構造は陰イオンを  、陽イオンを
、陽イオンを
 で表して図示すること。
結晶構造の名称を示す必要はない。
で表して図示すること。
結晶構造の名称を示す必要はない。
| a) | 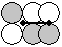 |
| b) |  |
| c) | 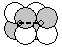 |
| d) | 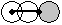 |
問 4. 酸素と硫黄の代表的な単体はそれぞれ O2, S8 である。このような違いの起こる理由を説明せよ。
問 5. 右の図 1 は二原子分子の分子軌道を模式的に示したものである。
a) - d) それぞれの軌道の C v 対称種 (
v 対称種 ( ,
,
 など)、軌道角運動量の分子軸への射影の量子数
など)、軌道角運動量の分子軸への射影の量子数
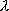 を示せ。
を示せ。
問 6. BF3, B2H6
分子に関して以下の問いに答えよ。
a) それぞれの構造を図示し、その対称性を点群の記号で示せ。
b) BF3 と比較して BH3 は不安定で二量体
B2H6 となりやすいのはなぜか。
c) 二量体 B2H6
に特有の結合について説明せよ。
問 7. 第6周期金属の中で、W は最高、Hg は最低の融点を持つ。
この理由を説明せよ。
問 8. 以下の反応における酸と塩基を判別せよ。
また平衡はどちらに偏っているかを ('右' または '左' で) 答えよ。
a) [AgCl2]-(aq) + 2 CN-(aq)
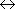 [Ag(CN)2]-(aq) +
2 Cl-(aq)
[Ag(CN)2]-(aq) +
2 Cl-(aq)
b) CH3HgI + HCl 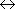 CH3HgCl + HI
CH3HgCl + HI
問 9. [Mn(NCS)6]4- の磁気モーメントを測定したら
6.06 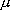 B であった。
磁気モーメントはほぼ spin only 式、
B であった。
磁気モーメントはほぼ spin only 式、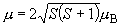 に従うとして、中心金属の電子配置を
t2gx
egy の形で示せ。
に従うとして、中心金属の電子配置を
t2gx
egy の形で示せ。
| 硬い | 中間 | 軟らかい | |
| 酸: | H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Cr2+, Cr3+, Al3+, SO3, BF3 |
Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Pb2+, SO2, BBr3 |
Cu+, Ag+, Au+,
Tl+, Hg+, Pd2+, Cd2+, Pt2+, Hg2+, BH3 |
| 塩基: | F-, Cl-, OH-, H2O, NH3, CO32-, NO3-, O2-, SO42-, PO43-, ClO4- |
NO2-, SO32-, Br-, N3-, N2, C6H5N, SCN- |
H-, R-, CN-,
CO, I-, SCN-, R3P, C6H6, R2S |
| (下線の原子が配位点) | |||
| 族 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 周 期 | ||||||||||||||||||
| 凡例 | ||||||||||||||||||
| 1 | 1.008 1H 2.20 |
原子量 原子番号
元素 電気陰性度 (Allred- Rochow) |
4.003 2He - | |||||||||||||||
| 2 | 6.941 3Li 0.97 |
9.012 4Be 1.47 |
10.81 5B 2.01 |
12.01 6C 2.50 |
14.01 7N 3.07 |
16.00 8O 3.50 |
19.00 9F 4.10 |
20.18 10Ne - | ||||||||||
| 3 | 22.99 11Na 1.01 |
24.31 12Mg 1.23 |
26.98 13Al 1.47 |
28.09 14Si 1.74 |
30.97 15P 2.06 |
32.07 16S 2.44 |
35.45 17Cl 2.83 |
39.95 18Ar - | ||||||||||
| 4 | 39.10 19K 0.91 |
40.08 20Ca 1.04 |
44.96 21Sc 1.20 |
47.87 22Ti 1.32 |
50.94 23V 1.45 |
52.00 24Cr 1.56 |
54.94 25Mn 1.60 |
55.85 26Fe 1.64 |
58.93 27Co 1.70 |
58.69 28Ni 1.75 |
63.55 29Cu 1.75 |
65.39 30Zn 1.66 |
69.72 31Ga 1.82 |
72.61 32Ge 2.02 |
74.92 33As 2.20 |
78.96 34Se 2.48 |
79.90 35Br 2.74 |
83.80 36Kr - |
| 5 | 85.47 37Rb 0.89 |
87.62 38Sr 0.99 |
88.91 39Y 1.11 |
91.22 40Zr 1.22 |
92.91 41Nb 1.23 |
95.94 42Mo 1.30 |
(99) 43Tc 1.36 |
101.1 44Ru 1.42 |
102.9 45Rh 1.45 |
106.4 46Pd 1.35 |
107.9 47Ag 1.42 |
112.4 48Cd 1.46 |
114.8 49In 1.49 |
118.7 50Sn 1.72 |
121.8 51Sb 1.82 |
127.6 52Te 2.01 |
126.9 53I 2.21 |
131.3 54Xe - |
| 6 | 132.9 55Cs 0.86 |
137.3 56Ba 0.97 |
La- Lu |
178.5 72Hf 1.23 |
180.9 73Ta 1.33 |
183.8 74W 1.40 |
186.2 75Re 1.46 |
190.2 76Os 1.52 |
192.2 77Ir 1.55 |
195.1 78Pt 1.44 |
197.0 79Au 1.42 |
200.6 80Hg 1.44 |
204.4 81Tl 1.44 |
207.2 82Pb 1.55 |
209.0 83Bi 1.67 |
(210) 84Po 1.76 |
(210) 85At 1.96 |
(222) 86Rn - |
| 7 | (223) 87Fr 0.86 |
(226) 88Ra 0.97 |
Ac- Lr |
(261) 104Rf - |
(262) 105Db - |
(263) 106Sg - |
(262) 107Bh - |
(265) 108Hs - |
(266) 109Mt - | |||||||||
| Lantha- noids (La-Lu) |
138.9 57La 1.03 |
140.1 58Ce 1.06 |
140.9 59Pr 1.07 |
144.2 60Nd 1.07 |
(145) 61Pm 1.07 |
150.4 62Sm 1.07 |
152.0 63Eu 1.01 |
157.3 64Gd 1.11 |
158.9 65Tb 1.10 |
162.5 66Dy 1.10 |
164.9 67Ho 1.10 |
167.3 68Er 1.11 |
168.9 69Tm 1.11 |
173.0 70Yb 1.06 |
175.0 71Lu 1.14 |
| Acti- noids (Ac-Lr) |
(227) 89Ac 1.00 |
232.0 90Th 1.11 |
231.0 91Pa 1.14 |
238.0 92U 1.22 |
(237) 93Np 1.22 |
(239) 94Pu 1.22 |
(243) 95Am ~1.2 |
(247) 96Cm ~1.2 |
(247) 97Bk ~1.2 |
(252) 98Cf ~1.2 |
(252) 99Es ~1.2 |
(257) 100Fm ~1.2 |
(258) 101Md ~1.2 |
(259) 102No - |
(262) 103Lr - |
|
担当教官: 三好 明 試験日時: 平成11年9月7日(火)10:50 〜 12:20(90分) 指定クラス: 2年理1(09-14, 29)・2年理23(01-06, 16) 教科書・ノート・資料などの持ち込みは不可 答案用紙: 両面2枚 (印刷不鮮明の場合以外、試験問題に関する質問は受 け付けない) |
物質化学(無機系化合物)試験問題
以下の問に答えよ。必要に応じて、下の周期律表を参照せよ。
 結合は不利になる。
この結果として化合物の安定な構造はどのように変化するか?
例を示して答えよ。
結合は不利になる。
この結果として化合物の安定な構造はどのように変化するか?
例を示して答えよ。[周期律表 (省略 - 2000 年度の問題と同様)]
|
担当教官: 三好 明 試験日時: 平成10年9月1日(火)10:50 〜 12:20(90分) 指定クラス: 2年理1(10-15, 29)・理23(01-02, 04-06, 16) 教科書・ノート・資料などの持ち込みは不可 答案用紙: 両面2枚 (印刷が不鮮明などの場合以外、試験問題に関する質問 は受け付けない。) |
物質化学(無機系化合物)試験問題
以下の問に答えよ。必要に応じて、 下の周期律表・電気陰性度の表を参照せよ。問題1
1) 構成原理に基づいて以下の原子の基底状態の電子配置を書け。
a) O (第 2 周期 16 族) b) Ni (第 4 周期 10 族)
2) 水素原子の 2s 軌道と 2p 軌道のエネルギーは等しい。第 2
周期以降の原子では 2s 軌道が 2p 軌道よりも低くなる理由を説明せよ。
3) 13-16 族典型元素化合物の以下の性質は、
周期律表を下がった時にどのように変化するか?
その理由を示して説明せよ。
a) ハロゲン化物の構造・結合のイオン性
b) 酸化物の構造・結合のイオン性・酸性-塩基性
4) ヘリウムやラドンが岩石中に存在している理由を説明せよ。
問題2
1) 気体の HCl, NaCl 分子の結合はどちらがイオン結合性が強いか?
理由を示して説明せよ。
2) PF5 分子の構造と結合形態を説明せよ。
3) B2H6 分子の構造を示し、
各々の結合の結合次数と結合の形態を説明せよ。
4) 第 3 遷移系列 (第 6 周期) 金属の融点は W(タングステン) で最高、
Hg(水銀) で最低となる。この理由を説明せよ。
問題3
1) O2 分子の分子軌道を示した上で、O2
分子とそのイオン (O22-, O2-,
O2, O2+) の結合次数を推定せよ。
2) 水溶液中で、亜塩素酸 (HOClO) と過塩素酸 (HOClO3)
はどちらが強い酸か? 理由を示して答えよ。
3) BF3, BCl3, BBr3
をルイス酸性の強い順に並べよ。またその理由を説明せよ。
[周期律表・電気陰性度の表 (省略 - 2000 年度の問題と同様)]